
今年4月6日,国内首款获批的FGFR抑制剂佩米替尼(Pemigatinib)上市!自此,FGFR靶向药逐渐进入大众的视野,对于FGFR靶点,目前上市的适应症主要为胆管癌和尿路上皮癌。而针对FGFR靶点,在非小细胞肺癌、肝癌、胃癌、乳腺癌等多种实体瘤中均有潜在获批希望,有望成为下一个不限癌种药物靶点。
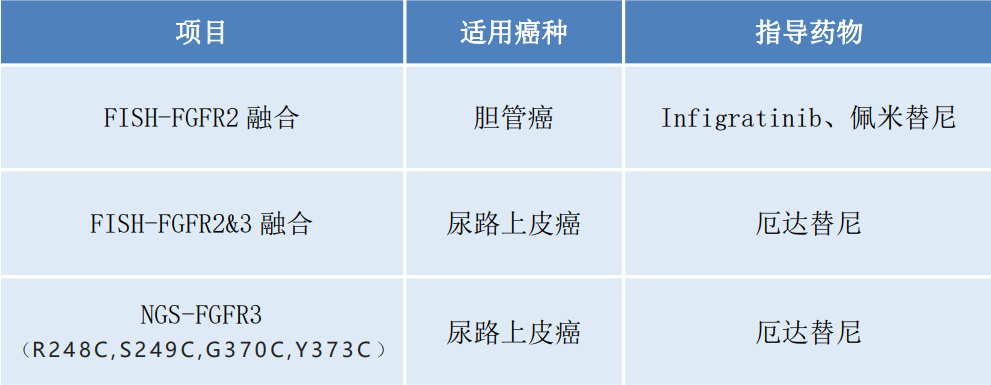
允英针对胆管癌及尿路上皮癌患者FGFR靶向精准用药推出FGFR2/3检测。通过荧光原位杂交技术(FISH)可以对常规福尔马林固定、石蜡包埋的组织细胞进行快速分子遗传学分析,得到FGFR2/3融合信息;高通量测序(NGS)检测FGFR3热点突变位点,共同指导患者FGFR靶向用药。
█ 一起了解FGFR基因FGFR,全称是成纤维细胞生长因子受体(Fibroblast Growth Factor Receptor),与EGFR同属于受体酪氨酸激酶(RTKs)家族。FGFR家族主要包括 FGFR1、FGFR2、FGFR3和FGFR4 四种亚型,各亚型均具有与配体结合的胞外区、跨膜区和受体磷酸化的胞内区的结构特点。FGFR分子改变可导致异常的FGF/FGFR信号,促进细胞增殖、新血管生成、侵袭、转移、抗凋亡等,这与广泛的人类恶性肿瘤有关。
目前在胆管癌、尿路上皮癌、乳腺癌、头颈癌、肺癌、胃癌、胰腺癌、结直肠癌、肾癌、子宫内膜癌、卵巢癌和宫颈癌中均报道过FGFR突变。
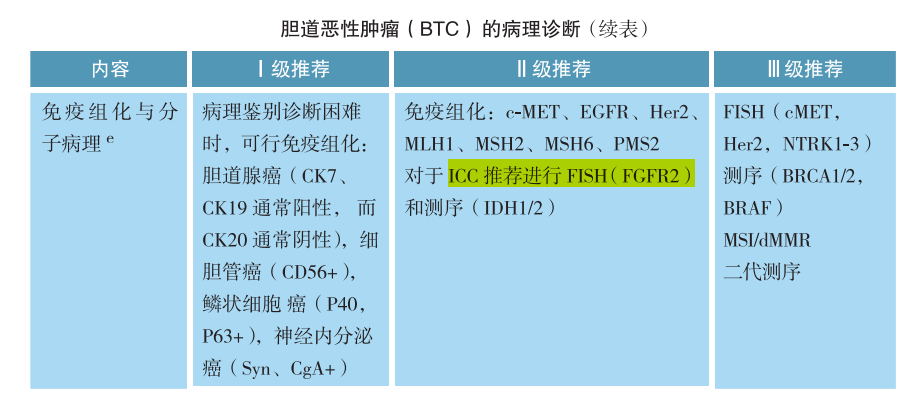
在胆管癌中:在肝内胆管癌患者中FGFR2的检出率为13-14%,FGFR2 不与其它突变类型共存。█ 指南推荐检测FGFR
○胆管癌
NCCN肿瘤学临床实践指南(NCCN指南®)建议对不可切除或转移性胆管癌患者进行分子检测,FGFR2融合或重排患者指导Infigratinib、佩米替尼治疗。
﹀
○尿路上皮癌
NCCN肿瘤学临床实践指南(NCCN指南®)推荐,针对铂类化疗进展的局部晚期或转移性尿路上皮癌的FGFR2/3基因变异的患者可接受厄达替尼治疗。

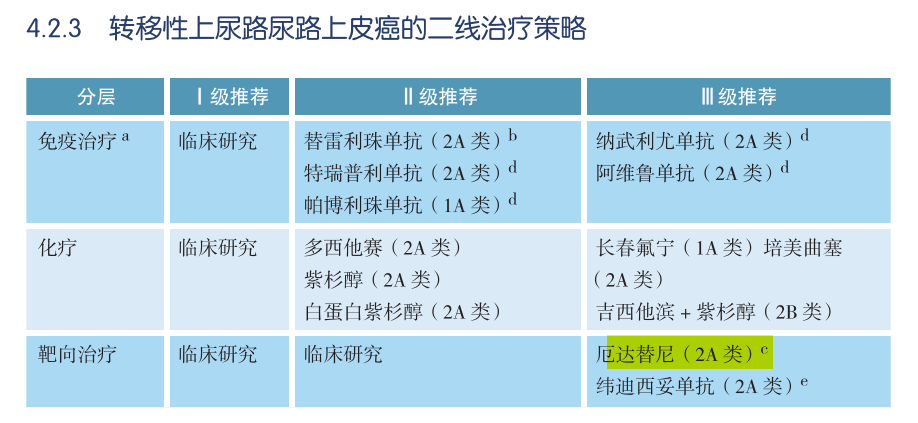
截取自中国临床肿瘤协会(CSCO)尿路上皮癌诊疗指南2021版
█ 国内外获批上市的FGFR药物✦ 2019年4月,FDA加速批准厄达替尼(Erdafitinib)用于治疗携带有FGFR3或FGFR2突变的铂类化疗后疾病进展的局部晚期或转移性尿路上皮癌成人患者,包括新辅助或辅助铂化疗12个月内的患者。
其获批是基于一项II期临床试验BLC2001的结果,该试验的更新数据显示,99例晚期FGFR基因突变的膀胱癌患者接受靶向治疗后,客观缓解率为40%。在既往接受过免疫治疗的22例患者中,客观缓解率为59%。中位无进展生存期为5.5个月,中位总生存期为13.8个月。
✦2021年5月29日,Infigratinib(Truseltiq)获FDA批准上市,用于治疗曾经接受过治疗的FGFR2融合及重排突变的局部晚期或转移性胆管癌患者。
其获批基于一项Ⅱ期临床研究数据,共纳入108例既往至少接受过一次治疗的FGFR2阳性晚期胆管癌患者。结果显示,接受Infigratinib治疗的患者中,客观缓解率为23%,中位无进展生存期7.3个月;发生响应的患者中,缓解持续超过6个月的患者占32%,中位缓解持续时间5.0个月。中位总生存期为12.2个月。该研究中,Infigratinib的安全性和耐受性良好。
✦2020年4月17日,Pemazyre™(pemigatinib)获FDA批准上市,用于针对已接受过治疗的携带有FGFR2融合或其他重排的基因突变,和不可切除的局部晚期或转移性胆管癌患者的治疗。
其获批基于FIGHT-202研究的数据。该研究在先前已接受过治疗的局部晚期或转移性胆管癌患者中开展,评估了pemigatinib的疗效和安全性。结果显示:在携带FGFR2融合或重排的患者(队列A)中,中位随访15个月,单药治疗的总缓解率为36%,中位缓解持续时间为9.1个月。该研究中,不良事件可控。
✦2022年4月6日,佩米替尼片(Pemigatinib)在中国获批上市,用于既往至少接受过一种系统性治疗,且经检测确认存在有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者的治疗。
其获批基于在中国晚期胆管癌患者的Ⅱ期临床研究数据,共纳入了31例FGFR2基因融合或重排阳性的胆管癌受试者。结果发现,在可评估的30名患者中,15名患者达到了疾病缓解,客观缓解率为50%。中位随访时间为5.13个月,12例患者仍处于病情缓解中。截止数据截止,无进展生存期的数据(PFS)尚未成熟。但疾病控制率(DCR)达到了100%。在安全性方面未出现严重的不良反应。
█ 允英FGFR2/3检测FISH是检测基因融合的“金标准”。FISH检测平台利用荧光探针,使肿瘤细胞中基因及染色体等微观分子病理现象可视化;实验周期短、特异性好、定位准确;结果判读在细胞形态的基础上进行,可有效降低假阴性或假阳性的风险。
高通量测序(NGS)检测FGFR3热点突变位点,共同指导患者FGFR靶向用药。
[8] Helsten T , Elkin S , Arthur E , et al. The FGFR Landscape in Cancer: Analysis of 4,853 Tumors by Next-Generation Sequencing[J]. Clinical Cancer Research An Official Journal of the American Association for Cancer Research, 2016, 22(1):259.




